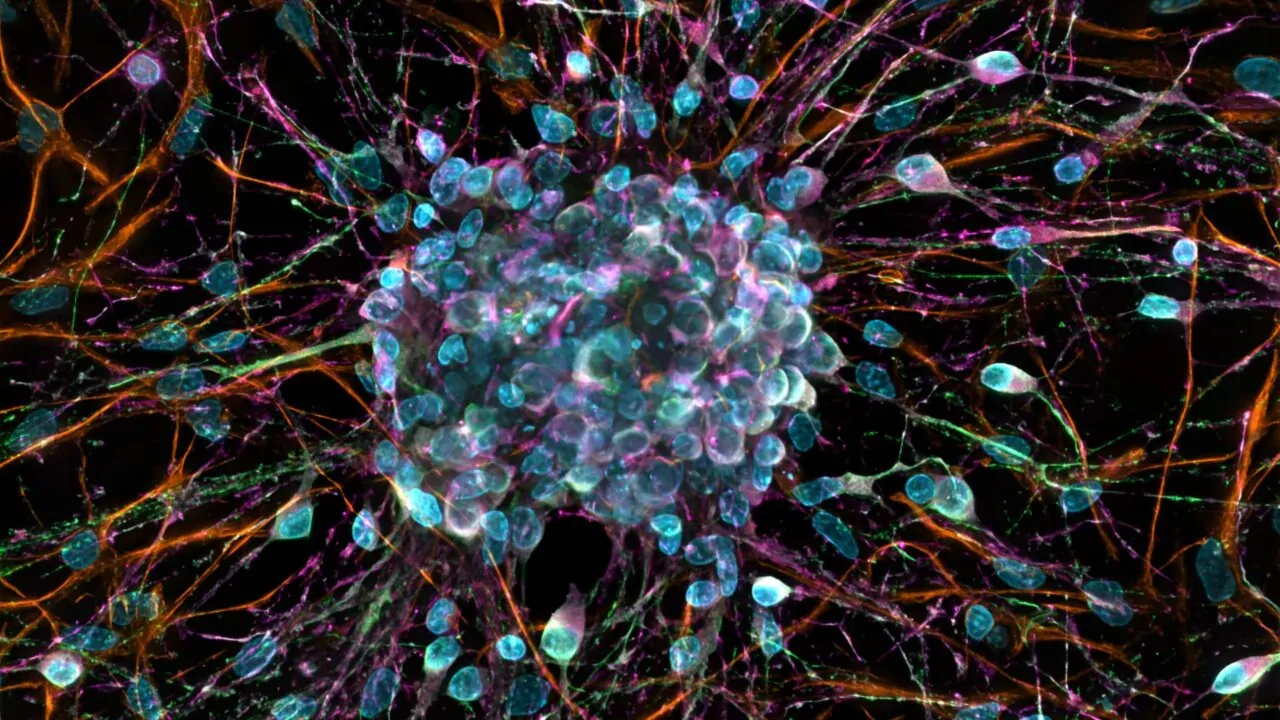
Każda komórka naszego ciała wytwarza napięcie elektryczne, które wpływa na to, czy się dzieli, przemieszcza i buduje tkanki. Zespół naukowców z Polskiej Akademii Nauk pokazuje, że manipulując tym parametrem, można sterować zachowaniem komórek bez ingerencji w ich DNA
Każda komórka posiada potencjał błonowy, czyli napięcie elektryczne generowane na jej błonie. To ono sprawia, że wnętrze komórki jest naładowane ujemnie względem środowiska zewnętrznego. – Jego wartość nie jest stała i zależy zarówno od rodzaju komórki, jak i od tego, w jakim jest ona stanie funkcjonalnym – wyjaśnia dr hab. Magdalena Kowacz, adiunkt w InLife Instytucie Rozrodu Zwierząt i Badań Żywności PAN.
– Komórki, które łatwo się dzielą i mają zdolność migracji, charakteryzują się mniej ujemnym potencjałem, czyli są zdepolaryzowane – wyjaśnia badaczka. – Z kolei komórki, które stabilnie pełnią swoje funkcje, mają potencjał bardziej ujemny.
Ten schemat powtarza się w wielu procesach biologicznych. – Zdepolaryzowane są komórki embrionalne, komórki biorące udział w regeneracji tkanek, ale także komórki nowotworowe – mówi Kowacz. – Wszystkie one mają wspólne cechy: szybko się dzielą, migrują i potrafią się samoorganizować.
To właśnie ta obserwacja stała się punktem wyjścia do badań. – Wykorzystujemy naturalny potencjał błonowy komórki, aby sterować jej zachowaniem – podkreśla badaczka. – Skoro wiemy, że różne stany funkcjonalne komórek odpowiadają różnym wartościom potencjału, możemy ten parametr celowo zmieniać.
Badania przeprowadzono na zarodkach kurzych, klasycznym modelu rozwoju kręgowców. Zespół skupił się na bardzo wczesnym etapie rozwoju. – Badamy etap somitogenezy, czyli moment, w którym powstają charakterystyczne segmenty ciała wspólne dla wszystkich kręgowców – wyjaśnia badaczka. – Na tym etapie zarodki kur, myszy i ludzi rozwijają się w bardzo podobny sposób.
U zarodków kurzych nowe segmenty powstają regularnie, co około 90 minut. Do tej pory, aby zmienić tempo tego procesu, należało ingerować bezpośrednio w geny. – My pokazujemy, że można osiągnąć ten efekt inaczej. Gdy zdepolaryzujemy komórki, szybciej się namnażają i migrują, a zarodek rozwija się szybciej. Z kolei zwiększenie ujemnego potencjału prowadzi do spowolnienia tego procesu.
Najbardziej intrygujące jest to, że zmiana napięcia elektrycznego wpływa na procesy kontrolowane genetycznie.
– Nie ingerujemy w DNA, a mimo to regulujemy proces, o którym wiemy, że jest sterowany genetycznie – podkreśla Kowacz. – Zmieniając potencjał błonowy, wpływamy również na ekspresję genów.
Choć badania mają charakter fundamentalny, ich znaczenie wykracza poza biologię rozwoju. Proces nowotworowy to tylko jeden z przykładów. – Istnieją choroby nadmiernej proliferacji, takie jak idiopatyczne włóknienie płuc, w których komórki spoczynkowe ponownie zaczynają się dzielić – zaznacza badaczka.
Podobny mechanizm pojawia się także w chorobie Alzheimera. W tym przypadku komórki próbują wrócić do cyklu komórkowego, choć kończy się to nie proliferacją, lecz neurodegeneracją.
Dr hab. Magdalena Kowacz podkreśla, że nie jest to gotowa propozycja terapeutyczna. – To są badania podstawowe, nie oferujemy nowej metody leczenia. Dokładamy jednak ważną cegiełkę do wiedzy, na której być może w przyszłości uda się zbudować rozwiązania medyczne.
Przedruk z czasopisma Academia Polskiej Akademii Nauk.